Validação de sistemas: o que você precisa saber?
Com a chegada de novas resoluções e atualizações de outras do setor farmacêutico, como por exemplo a RDC 430/2020 e sua atualização através da RDC 653/2022 e a nova RDC 658/2022 e suas instruções normativas como a IN 134/2022, fica cada vez mais evidente a necessidade de se validação um sistema computadorizado.

Mas a verdade é que um assunto muito nebuloso para muitos profissionais da área, gerando muitas dúvidas e falhas de comunicação quando o assunto envolve os profissionais da T.I, farmacêuticos e empresas contratantes e contratadas. Levando-se em consideração as principais dúvidas que levantamos de alguns clientes resolvemos fazer um especial tudo o que você precisa saber sobre Validação de Sistemas Computadorizados.
A tecnologia faz parte da nossa rotina do dia a dia, a encontramos no nosso trabalho, em nosso celular, atividades de lazer e em praticamente todas as ocasiões. Na Indústria regulada não poderia ser diferente, com a Indústria 4.0 é muito comum nos depararmos com tecnologias inovadoras que trazem mais agilidade ao processo e consequentemente maior ganho de produção.
Com todas essas inovações, a Agência Nacional de Vigilância Sanitária (ANVISA) vem buscando atualizar as Indústrias Reguladas, bem como a sua cadeia de distribuição e logística, com a publicação de guias, normas e legislações como é o caso do Guia 33 de Validação de Sistemas Computadorizados, Instrução normativa 134/2022 e Resolução da Diretoria Colegiada (RDC 658/2022), esses guias, normas e legislações tem como objetivo determinar e orientar os caminhos para a conciliação da tecnologia inovadora e as boas práticas de fabricação, distribuição e armazenagem.
Qualquer Sistema computadorizado precisa ser validado?
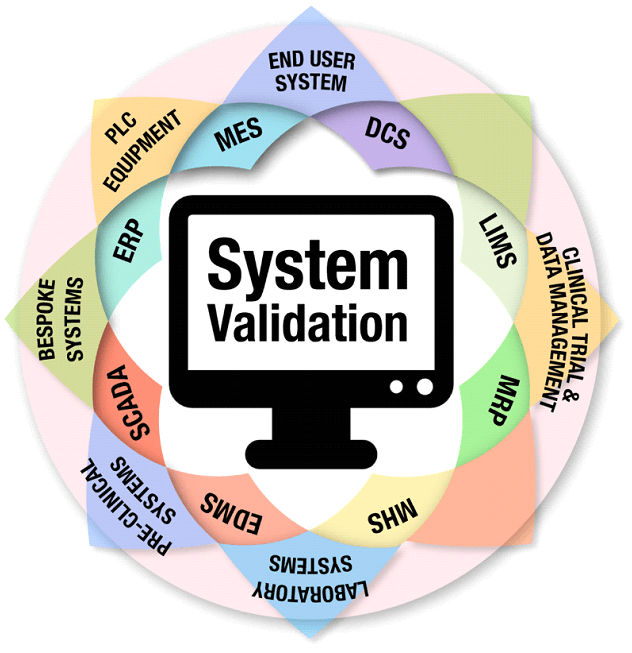
A necessidade ou não de Validar um Sistema Computadorizado é uma das principais dúvidas da Empresa regulada, pois dentro de um processo existem inúmeros Sistemas que são utilizados, alguns vinculados diretamente com o processo produtivo, como por exemplo, Sistemas de automação de Equipamentos de Produção, Sistemas de tratamento de ar (HVAC), Sistemas de tratamento e distribuição de água e outros Sistemas que não estão vinculados diretamente com o processo produção da Indústria, mas estão vinculados ao processo de distribuição e logística, como é o caso de Sistemas ERP (Enterprise Resource Planning) que são utilizados para a entrada de mercadorias via nota fiscal, processo de venda e devolução.
E ainda se tem outros Sistemas que são utilizados em outros processos, como por exemplo, controle de versão de documentos, controle de treinamento e até mesmo Planilhas Eletrônicas, isso mesmo, Planilhas eletrônicas elaboradas com o Microsoft Excel devem ter avaliação de risco para a determinação da necessidade ou não do processo de Validação.
Pois bem, então, como sabermos quais Sistemas e Planilhas eletrônicas precisam passar por um processo de validação? A Qualifica, baseada em guias, normas e legislações, faz juntamente com o nosso cliente, a execução de um check-list de riscos para o seu Sistema computadorizado ou Planilha eletrônica e dessa forma justificamos a necessidade ou não da realização de um processo de Validação, onde se o Sistema computadorizado ou Planilha eletrônica possui relevância, é iniciado o processo de Validação e caso não possuir relevância a mesma estará justificada e pronta para a demonstração em inspeções da Vigilância Sanitária.
Com todas essas inovações tecnológicas e exigências da ANVISA, as Empresas que fazem parte do processo regulado precisam se adequar a este Sistema da Qualidade e para isso, a Qualifica possui consultores que vão lhe conduzir com um passo a passo para a implantação de um Sistema da Qualidade eficiente e determinar se os seus Sistemas Computadorizados possuem relevância e necessitam passar por um processo de Validação conforme o que preconiza os guias, normas e legislações vigentes. Entre em contato conosco e saiba mais
Como é feito uma Validação de Sistemas Computadorizados?
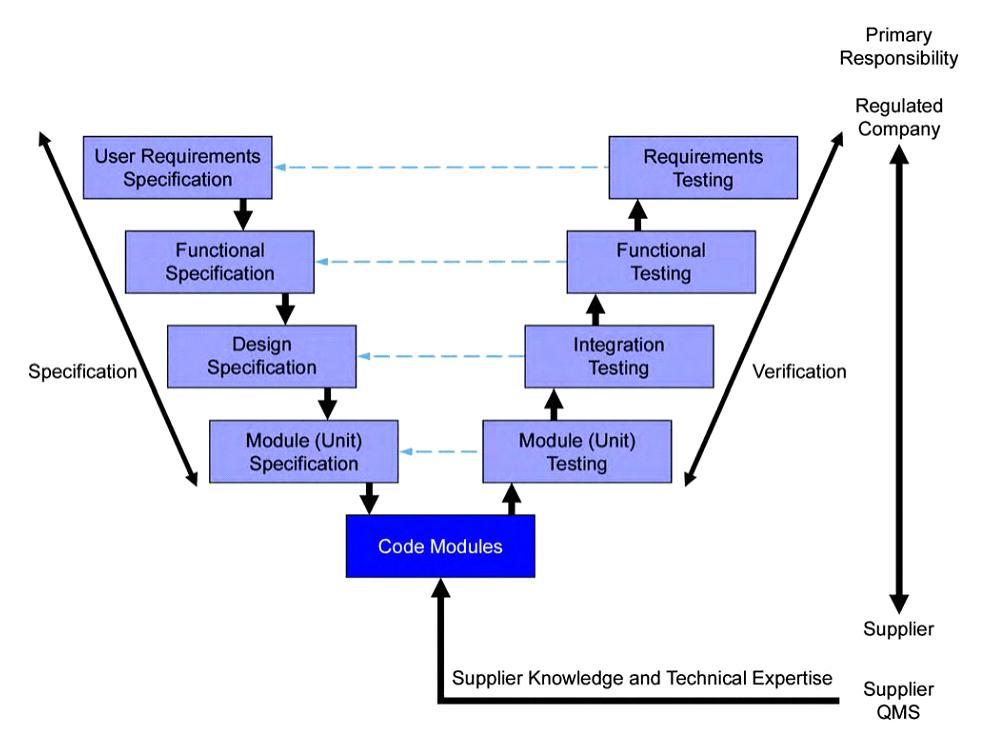
Mediante a constatação da relevância do Sistema Computadorizado, será iniciado o processo de Validação do Sistema e de fato esse será um processo, no qual serão envolvidos os donos do Sistema, donos do processo, consultoria, fornecedor do Sistema e demais Equipes Técnicas, sendo de extrema importância a formação deste comitê de Validação, pois este processo é iniciado com uma análise de risco prévia do Sistema e dos processos que o mesmo está envolvido e neste processo a expertise das áreas e processos envolvidas é de grande valia. Nós da Qualifica, nos baseamos em guias como o GAMP5 do ISPE e Guias, Instruções e Legislações da ANVISA para a realização deste processo. O processo de Validação seguirá um fluxo de documentação que partirá da elaboração de requisitos necessários por parte do cliente, por parte da Empresa contratante e das legislações aplicadas e desta maneira serão utilizados documentos de suporte como manuais, diagramas e procedimentos para a elaboração de riscos funcionais e não funcionais que serão determinantes para a elaboração e execução dos testes de instalação, operação e desempenho do Sistema Computadorizado. Mediante ao término da etapa de testes será elaborado um relatório de validação com a explicação de todo o processo, bem como o status de validação obtido pelo Sistema. Abaixo é possível visualizar um fluxo resumido do processo de Validação de um Sistema computadorizado:
Meu Sistema está validado, meu “problema” acabou?
Após o processo de Validação do Sistema Computadorizado e a obtenção do Status de “Sistema Validado”, a empresa regulada deu o primeiro e principal passo para que a sua Empresa esteja em compliance com as normas requisitadas pela agência reguladora (ANVISA), porém este status de “Sistema validado” deverá ser mantido e a pergunta é: “Como manter o meu sistema validado?”. Para a manutenção do status de validação de um Sistema Computadorizado é necessário que todas as manutenções, correções de bugs, alterações ou customizações funcionais, atualização de banco de dados ou servidor sejam devidamente gerenciadas por um sistema de gerenciamento de mudanças que deve ser estabelecido dentro do Sistema da Qualidade da Empresa regulada. De acordo com a ANVISA, “O controle de mudanças é um sistema formalizado pelo qual representantes qualificados das áreas apropriadas reveem propostas de mudanças ou mudanças que podem afetar o estado validado de instalações, sistemas, equipamentos ou processos. O objetivo é determinar a necessidade de ações para assegurar e documentar que o sistema é mantido dentro do estado validado”. Dessa forma o gerenciamento do controle de mudanças do Sistema deve ser realizado até a descontinuação do mesmo, sendo que a Empresa regulada deverá determinar um tempo periódico para a elaboração de um documento de revisão periódica do Sistema, documento este que deve detalhar todas as mudanças geradas para o Sistema durante o período determinado e se tais mudanças e ou manutenções acarretaram ou não em uma validação parcial do Sistema, sendo que uma justificativa baseada em riscos e elaborada pelo comitê de controle de mudanças deve ser elaborada, sendo a mudança relevante ou não para o status de validação do Sistema.
Planilhas eletrônicas, como realizar o processo de Validação?
Planilhas eletrônicas, são amplamente utilizadas em processos de uma Indústria Regulada ou Empresas de distribuição e logística, é praticamente impossível a não utilização dessa tecnologia. O guia 33 de Validação de Sistemas Computadorizados da ANVISA, traz um capítulo inteiro sobre este assunto (capítulo 14), neste guia estão ilustrados os tipos de planilhas mais comumente utilizados dentro de um processo regulado conforme vamos ver abaixo:
Planilhas descartáveis: São planilhas utilizadas do mesmo modo que uma calculadora, para realização de cálculos, sendo que não é mantida uma cópia eletrônica desta operação.
Planilhas Retidas como Documentos: São utilizadas como um processador de texto e não como uma aplicação tradicional. A principal diferença é que a planilha pode ser utilizada tanto para registrar dados BPF quanto para manipulá-los. Dessa forma, se faz aconselhável gerenciá-las como documentos e não como aplicação.
Planilhas Utilizadas como Banco de Dados no servidor e em área de trabalho do Computador (stand alone): São planilhas utilizadas para gerenciar ou armazenar dados BPF eletronicamente. Os dados podem ser atualizados com frequência, o que pode causar dificuldades em assegurar a integridade dos dados.
Aplicações do Tipo Template: Os templates podem ser utilizados por exemplo para a tabulação e processamento de dados de um estudo clínico ou, similarmente para tabulação e processamento de dado de resultados de testes de controle de qualidade antes da liberação do produto. Ao desenvolver tais templates, usuários e desenvolvedores devem entender e documentar totalmente a manipulação necessária.



Deixe uma resposta