Validação de sistemas: o que você precisa saber?
Com a chegada de novas resoluções e atualizações de outras do setor farmacêutico, como por exemplo a RDC 430/2020 e sua atualização através da RDC 653/2022 e a nova RDC 658/2022 e suas instruções normativas como a IN 134/2022, fica cada vez mais evidente a necessidade de se validação um sistema computadorizado.

Mas a verdade é que um assunto muito nebuloso para muitos profissionais da área, gerando muitas dúvidas e falhas de comunicação quando o assunto envolve os profissionais da T.I, farmacêuticos e empresas contratantes e contratadas. Levando-se em consideração as principais dúvidas que levantamos de alguns clientes resolvemos fazer um especial tudo o que você precisa saber sobre Validação de Sistemas Computadorizados.
A tecnologia faz parte da nossa rotina do dia a dia, a encontramos no nosso trabalho, em nosso celular, atividades de lazer e em praticamente todas as ocasiões. Na Indústria regulada não poderia ser diferente, com a Indústria 4.0 é muito comum nos depararmos com tecnologias inovadoras que trazem mais agilidade ao processo e consequentemente maior ganho de produção.
Com todas essas inovações, a Agência Nacional de Vigilância Sanitária (ANVISA) vem buscando atualizar as Indústrias Reguladas, bem como a sua cadeia de distribuição e logística, com a publicação de guias, normas e legislações como é o caso do Guia 33 de Validação de Sistemas Computadorizados, Instrução normativa 134/2022 e Resolução da Diretoria Colegiada (RDC 658/2022), esses guias, normas e legislações tem como objetivo determinar e orientar os caminhos para a conciliação da tecnologia inovadora e as boas práticas de fabricação, distribuição e armazenagem.
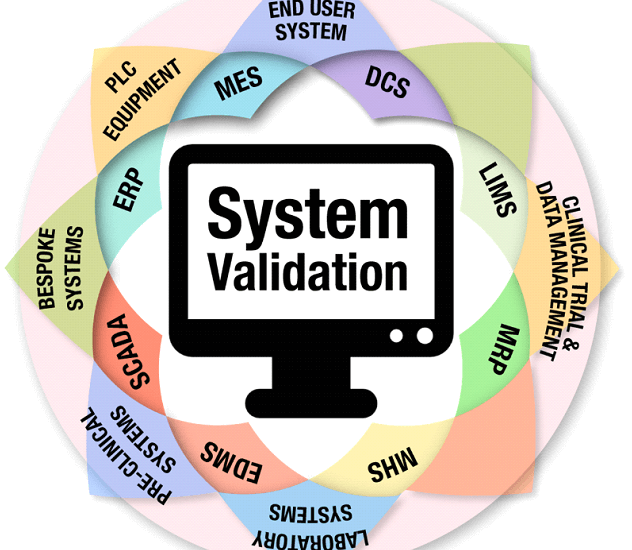
Qualquer Sistema computadorizado precisa ser validado?
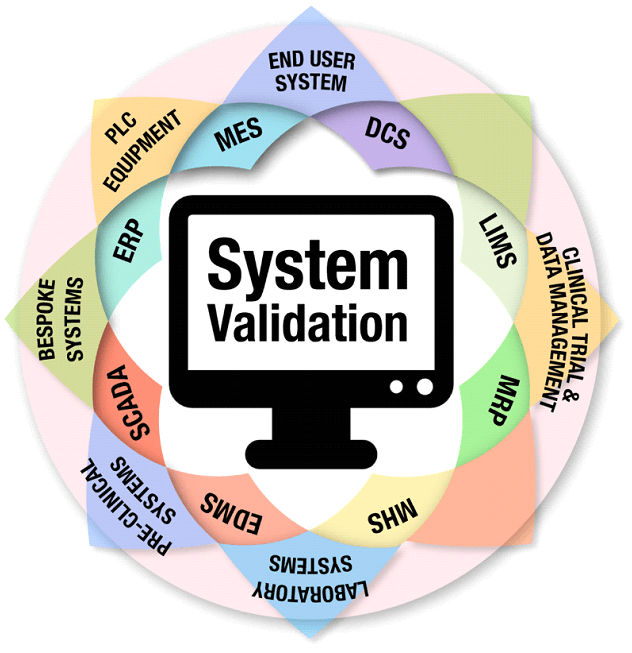
A necessidade ou não de Validar um Sistema Computadorizado é uma das principais dúvidas da Empresa regulada, pois dentro de um processo existem inúmeros Sistemas que são utilizados, alguns vinculados diretamente com o processo produtivo, como por exemplo, Sistemas de automação de Equipamentos de Produção, Sistemas de tratamento de ar (HVAC), Sistemas de tratamento e distribuição de água e outros Sistemas que não estão vinculados diretamente com o processo produção da Indústria, mas estão vinculados ao processo de distribuição e logística, como é o caso de Sistemas ERP (Enterprise Resource Planning) que são utilizados para a entrada de mercadorias via nota fiscal, processo de venda e devolução.
E ainda se tem outros Sistemas que são utilizados em outros processos, como por exemplo, controle de versão de documentos, controle de treinamento e até mesmo Planilhas Eletrônicas, isso mesmo, Planilhas eletrônicas elaboradas com o Microsoft Excel devem ter avaliação de risco para a determinação da necessidade ou não do processo de Validação.
Pois bem, então, como sabermos quais Sistemas e Planilhas eletrônicas precisam passar por um processo de validação? A Qualifica, baseada em guias, normas e legislações, faz juntamente com o nosso cliente, a execução de um check-list de riscos para o seu Sistema computadorizado ou Planilha eletrônica e dessa forma justificamos a necessidade ou não da realização de um processo de Validação, onde se o Sistema computadorizado ou Planilha eletrônica possui relevância, é iniciado o processo de Validação e caso não possuir relevância a mesma estará justificada e pronta para a demonstração em inspeções da Vigilância Sanitária.
Com todas essas inovações tecnológicas e exigências da ANVISA, as Empresas que fazem parte do processo regulado precisam se adequar a este Sistema da Qualidade e para isso, a Qualifica possui consultores que vão lhe conduzir com um passo a passo para a implantação de um Sistema da Qualidade eficiente e determinar se os seus Sistemas Computadorizados possuem relevância e necessitam passar por um processo de Validação conforme o que preconiza os guias, normas e legislações vigentes. Entre em contato conosco e saiba mais
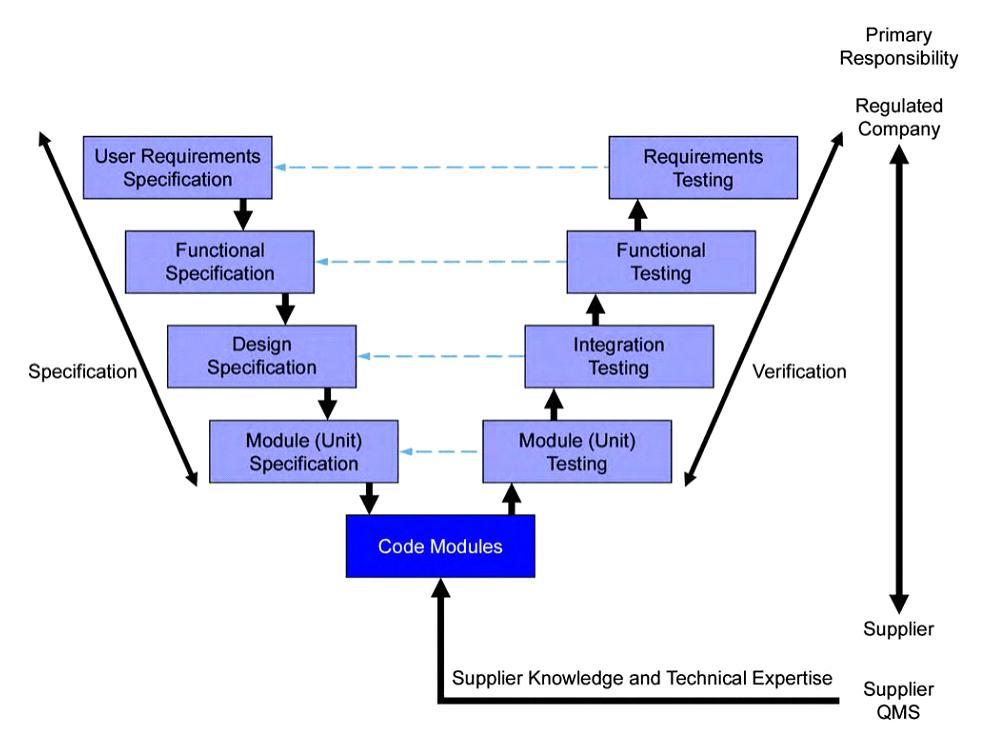
Como é feito uma Validação de Sistemas Computadorizados?
Mediante a constatação da relevância do Sistema Computadorizado, será iniciado o processo de Validação do Sistema e de fato esse será um processo, no qual serão envolvidos os donos do Sistema, donos do processo, consultoria, fornecedor do Sistema e demais Equipes Técnicas, sendo de extrema importância a formação deste comitê de Validação, pois este processo é iniciado com uma análise de risco prévia do Sistema e dos processos que o mesmo está envolvido e neste processo a expertise das áreas e processos envolvidas é de grande valia. Nós da Qualifica, nos baseamos em guias como o GAMP5 do ISPE e Guias, Instruções e Legislações da ANVISA para a realização deste processo. O processo de Validação seguirá um fluxo de documentação que partirá da elaboração de requisitos necessários por parte do cliente, por parte da Empresa contratante e das legislações aplicadas e desta maneira serão utilizados documentos de suporte como manuais, diagramas e procedimentos para a elaboração de riscos funcionais e não funcionais que serão determinantes para a elaboração e execução dos testes de instalação, operação e desempenho do Sistema Computadorizado. Mediante ao término da etapa de testes será elaborado um relatório de validação com a explicação de todo o processo, bem como o status de validação obtido pelo Sistema. Abaixo é possível visualizar um fluxo resumido do processo de Validação de um Sistema computadorizado:
Meu Sistema está validado, meu “problema” acabou?
Após o processo de Validação do Sistema Computadorizado e a obtenção do Status de “Sistema Validado”, a empresa regulada deu o primeiro e principal passo para que a sua Empresa esteja em compliance com as normas requisitadas pela agência reguladora (ANVISA), porém este status de “Sistema validado” deverá ser mantido e a pergunta é: “Como manter o meu sistema validado?”. Para a manutenção do status de validação de um Sistema Computadorizado é necessário que todas as manutenções, correções de bugs, alterações ou customizações funcionais, atualização de banco de dados ou servidor sejam devidamente gerenciadas por um sistema de gerenciamento de mudanças que deve ser estabelecido dentro do Sistema da Qualidade da Empresa regulada. De acordo com a ANVISA, “O controle de mudanças é um sistema formalizado pelo qual representantes qualificados das áreas apropriadas reveem propostas de mudanças ou mudanças que podem afetar o estado validado de instalações, sistemas, equipamentos ou processos. O objetivo é determinar a necessidade de ações para assegurar e documentar que o sistema é mantido dentro do estado validado”. Dessa forma o gerenciamento do controle de mudanças do Sistema deve ser realizado até a descontinuação do mesmo, sendo que a Empresa regulada deverá determinar um tempo periódico para a elaboração de um documento de revisão periódica do Sistema, documento este que deve detalhar todas as mudanças geradas para o Sistema durante o período determinado e se tais mudanças e ou manutenções acarretaram ou não em uma validação parcial do Sistema, sendo que uma justificativa baseada em riscos e elaborada pelo comitê de controle de mudanças deve ser elaborada, sendo a mudança relevante ou não para o status de validação do Sistema.
Planilhas eletrônicas, como realizar o processo de Validação?
Planilhas eletrônicas, são amplamente utilizadas em processos de uma Indústria Regulada ou Empresas de distribuição e logística, é praticamente impossível a não utilização dessa tecnologia. O guia 33 de Validação de Sistemas Computadorizados da ANVISA, traz um capítulo inteiro sobre este assunto (capítulo 14), neste guia estão ilustrados os tipos de planilhas mais comumente utilizados dentro de um processo regulado conforme vamos ver abaixo:
Planilhas descartáveis: São planilhas utilizadas do mesmo modo que uma calculadora, para realização de cálculos, sendo que não é mantida uma cópia eletrônica desta operação.
Planilhas Retidas como Documentos: São utilizadas como um processador de texto e não como uma aplicação tradicional. A principal diferença é que a planilha pode ser utilizada tanto para registrar dados BPF quanto para manipulá-los. Dessa forma, se faz aconselhável gerenciá-las como documentos e não como aplicação.
Planilhas Utilizadas como Banco de Dados no servidor e em área de trabalho do Computador (stand alone): São planilhas utilizadas para gerenciar ou armazenar dados BPF eletronicamente. Os dados podem ser atualizados com frequência, o que pode causar dificuldades em assegurar a integridade dos dados.
Aplicações do Tipo Template: Os templates podem ser utilizados por exemplo para a tabulação e processamento de dados de um estudo clínico ou, similarmente para tabulação e processamento de dado de resultados de testes de controle de qualidade antes da liberação do produto. Ao desenvolver tais templates, usuários e desenvolvedores devem entender e documentar totalmente a manipulação necessária.
FDA 21 CFR Part 11 – Saiba mais sobre essa norma
 A FDA 21 CFR Part 11 é uma regulamentação criada pela Administração de Medicamentos e Alimentos dos Estados Unidos (FDA) que define os critérios para o uso de registros eletrônicos e assinaturas eletrônicas em ambientes regulamentados. Esse conjunto de regras é aplicável a empresas relacionadas à saúde nos Estados Unidos e tem impacto significativo na validação de sistemas computadorizados em todo o mundo.
A FDA 21 CFR Part 11 é uma regulamentação criada pela Administração de Medicamentos e Alimentos dos Estados Unidos (FDA) que define os critérios para o uso de registros eletrônicos e assinaturas eletrônicas em ambientes regulamentados. Esse conjunto de regras é aplicável a empresas relacionadas à saúde nos Estados Unidos e tem impacto significativo na validação de sistemas computadorizados em todo o mundo.
A FDA é o órgão regulador responsável por supervisionar as empresas de interesse à saúde nos Estados Unidos. A 21 CFR Part 11 é uma normativa elaborada por esse órgão e serve como referência para a validação de sistemas computadorizados em diversos países. Sua influência transcende fronteiras, já que muitos órgãos reguladores em todo o mundo consideram essa regulamentação como base para seus próprios requisitos em relação a sistemas computadorizados.
Essa normativa tem como objetivo garantir a segurança, a integridade e a confiabilidade dos registros eletrônicos e assinaturas eletrônicas utilizados em ambientes regulamentados. Ela estabelece requisitos específicos para a autenticação, a proteção de dados, as auditorias e a retenção de registros eletrônicos. A conformidade com a 21 CFR Part 11 é essencial para garantir que os sistemas computadorizados utilizados cumpram as exigências regulatórias e possam ser considerados confiáveis.
No contexto da validação de sistemas computadorizados, a 21 CFR Part 11 desempenha um papel fundamental. Essa regulamentação orienta as empresas no desenvolvimento e na implementação de sistemas computadorizados que atendam aos padrões de segurança e integridade exigidos pela FDA. Ela estabelece diretrizes claras para a documentação adequada, os testes rigorosos e a qualificação de equipamentos, garantindo a conformidade e a confiabilidade dos sistemas utilizados em ambientes regulamentados.
 A conformidade com a 21 CFR Part 11 inclui aspectos como a implementação de controles de acesso adequados, a proteção dos dados contra alterações não autorizadas e a manutenção adequada dos registros eletrônicos. Esses requisitos são essenciais para garantir a validade e a rastreabilidade das informações armazenadas nos sistemas computadorizados.
A conformidade com a 21 CFR Part 11 inclui aspectos como a implementação de controles de acesso adequados, a proteção dos dados contra alterações não autorizadas e a manutenção adequada dos registros eletrônicos. Esses requisitos são essenciais para garantir a validade e a rastreabilidade das informações armazenadas nos sistemas computadorizados.
Em resumo, a FDA 21 CFR Part 11 é uma regulamentação elaborada pela Administração de Medicamentos e Alimentos dos Estados Unidos (FDA) para garantir a segurança, a integridade e a confiabilidade dos registros eletrônicos e assinaturas eletrônicas em ambientes regulamentados. Essa normativa serve como base para a validação de sistemas computadorizados em todo o mundo, fornecendo diretrizes claras para a conformidade e a confiabilidade dos sistemas utilizados. A conformidade com a 21 CFR Part 11 é essencial para as empresas de interesse à saúde, garantindo que seus sistemas cumpram as exigências regulatórias e sejam considerados confiáveis e seguros.
A Qualifica é uma empresa especializada em serviços de assessoria e consultoria com ênfase para a área de qualificação e validação, oferecendo o serviço de mapeamento térmico de rotas e áreas, qualificação de equipamentos e veículos refrigerados, validação de sistemas computadorizados e qualificação de embalagens térmicas. Com uma abordagem objetiva e experiente, a Qualifica auxilia as empresas a atenderem aos requisitos regulatórios e garantirem a segurança e qualidade de seus processos de transporte e armazenamento de produtos sensíveis à temperatura. Saiba mais sobre a nossa consultoria e assessoria e entre em contato
Validação de Sistemas Computadorizados no Mercado Farmacêutico: Garantindo a Confiabilidade e Qualidade

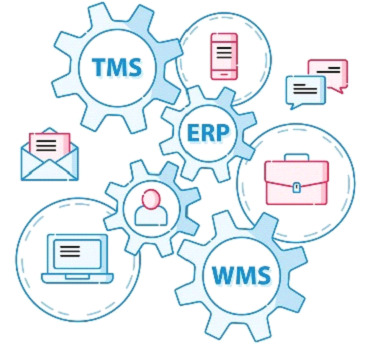
No setor farmacêutico, a garantia da qualidade e a conformidade com as regulamentações são fundamentais. Nesse contexto, a validação de sistemas computadorizados desempenha um papel crucial. A validação assegura que os sistemas utilizados, como Enterprise Resource Planning (ERP), Warehouse Management System (WMS), Transportation Management System (TMS) e Global Positioning System (GPS), estejam em conformidade com os requisitos regulatórios e funcionem de maneira confiável. Neste artigo, abordaremos os principais aspectos da validação de sistemas computadorizados, com ênfase no mercado farmacêutico.
A validação de sistemas computadorizados é o processo pelo qual se confirma que um sistema atende aos requisitos definidos, resultando em um ambiente seguro e confiável. Essa validação é essencial no setor farmacêutico, pois os sistemas computadorizados são amplamente utilizados em todas as etapas da cadeia de suprimentos, desde o controle de qualidade até a distribuição dos medicamentos. A validação garante que esses sistemas operem corretamente, sejam precisos e consistentes, além de estarem em conformidade com as regulamentações específicas do setor.
 Para identificar se um sistema é validável, é necessário seguir as orientações estabelecidas em algumas normativas, uma delas é o Guia nº 33 da Agência Nacional de Vigilância Sanitária (Anvisa), um guia baseado nas diretrizes do GAMP-5 sobre validação de sistemas. Esse guia fornece diretrizes detalhadas sobre os requisitos e boas práticas para a validação de sistemas computadorizados. O primeiro passo é realizar uma análise de risco, identificando os possíveis impactos que falhas no sistema podem causar aos processos farmacêuticos. Com base nessa análise, é possível determinar se o sistema é crítico e requer validação.
Para identificar se um sistema é validável, é necessário seguir as orientações estabelecidas em algumas normativas, uma delas é o Guia nº 33 da Agência Nacional de Vigilância Sanitária (Anvisa), um guia baseado nas diretrizes do GAMP-5 sobre validação de sistemas. Esse guia fornece diretrizes detalhadas sobre os requisitos e boas práticas para a validação de sistemas computadorizados. O primeiro passo é realizar uma análise de risco, identificando os possíveis impactos que falhas no sistema podem causar aos processos farmacêuticos. Com base nessa análise, é possível determinar se o sistema é crítico e requer validação.
Dentre os aspectos-chave da validação de sistemas computadorizados no mercado farmacêutico, destacam-se a gestão de backups, a gestão de senhas e a hierarquização. O backup é fundamental para garantir a integridade dos dados e a recuperação de informações em caso de falhas ou incidentes. É essencial implementar políticas de backup regulares e testar sua eficácia. Já a gestão de senhas deve seguir princípios de segurança, garantindo que apenas usuários autorizados tenham acesso ao sistema. A hierarquização é necessária para definir níveis de acesso e permissões de usuários, garantindo que apenas as pessoas adequadas tenham acesso a determinadas funcionalidades do sistema. Uma metodologia interessante para seguir o passo a passo para a validação de sistemas pode ser encontrada na norma da FDA 21 CFR Part 11
Além disso, é importante entender a diferença entre software e hardware na validação de sistemas computadorizados. O software refere-se aos programas e aplicativos utilizados no sistema, enquanto o hardware se refere aos dispositivos físicos, como computadores, servidores e dispositivos de armazenamento. Ambos devem ser validados, garantindo que o software esteja em conformidade e funcionando corretamente no hardware escolhido. É necessário realizar testes e verificações em ambas as partes para assegurar a conformidade e a operação adequada do sistema como um todo.

No mercado farmacêutico, diferentes tipos de sistemas computadorizados são amplamente utilizados. O ERP é um sistema integrado que gerencia diversas áreas do negócio, como vendas, estoque, compras e finanças. O WMS é responsável pelo gerenciamento de estoque em armazéns e centros de distribuição. O TMS é utilizado para o gerenciamento de transporte e logística, controlando rotas, frota e rastreamento de cargas. O GPS é utilizado para monitorar a localização de veículos em tempo real. Cada um desses sistemas requer validação adequada para garantir sua conformidade com as regulamentações e sua eficiência operacional.
 Em resumo, a validação de sistemas computadorizados desempenha um papel fundamental no mercado farmacêutico, garantindo a confiabilidade, a segurança e a conformidade dos sistemas utilizados. É necessário seguir as orientações do Guia nº 33 da Anvisa e implementar boas práticas, como gestão de backups, gestão de senhas e hierarquização. Compreender a diferença entre software e hardware é essencial para a validação adequada. Além disso, os diferentes tipos de sistemas, como ERP, WMS, TMS e GPS, devem passar por processos de validação para garantir sua eficácia e conformidade. Ao realizar a validação de sistemas computadorizados, as empresas farmacêuticas podem garantir a qualidade de seus processos e produtos, bem como a segurança dos pacientes.
Em resumo, a validação de sistemas computadorizados desempenha um papel fundamental no mercado farmacêutico, garantindo a confiabilidade, a segurança e a conformidade dos sistemas utilizados. É necessário seguir as orientações do Guia nº 33 da Anvisa e implementar boas práticas, como gestão de backups, gestão de senhas e hierarquização. Compreender a diferença entre software e hardware é essencial para a validação adequada. Além disso, os diferentes tipos de sistemas, como ERP, WMS, TMS e GPS, devem passar por processos de validação para garantir sua eficácia e conformidade. Ao realizar a validação de sistemas computadorizados, as empresas farmacêuticas podem garantir a qualidade de seus processos e produtos, bem como a segurança dos pacientes.
A Qualifica é uma empresa especializada em serviços de assessoria e consultoria com ênfase para a área de qualificação e validação, oferecendo o serviço de mapeamento térmico de rotas e áreas, qualificação de equipamentos e veículos refrigerados, validação de sistemas computadorizados e qualificação de embalagens térmicas. Com uma abordagem objetiva e experiente, a Qualifica auxilia as empresas a atenderem aos requisitos regulatórios e garantirem a segurança e qualidade de seus processos de transporte e armazenamento de produtos sensíveis à temperatura. Saiba mais sobre a nossa consultoria e assessoria e entre em contato
Adequação da RDC 653-2022 Planos de Ação para Sistemas Ativos e Sistemas Passivos de Controle de Temperatura

A Resolução de Diretoria Colegiada (RDC) 653/2022 estabelece novos prazos e requisitos para o transporte de produtos termolábeis, ou seja, aqueles que requerem controle de temperatura durante o seu transporte. Essa regulamentação determina a necessidade de estudos de mapeamento das rotas por dois anos, seguido por um ano adicional para a adequação das frotas. Nesse contexto, é essencial compreender as diferenças entre sistemas ativos e sistemas passivos de controle de temperatura, bem como desenvolver planos de ação adequados para a frota, levando em consideração aspectos de qualidade, técnicos e financeiros.

Os sistemas ativos de controle são caracterizados por terem um controle ativo de temperatura e/ou umidade, permitindo o ajuste automático às variações da temperatura externa. Exemplos de sistemas ativos incluem contêineres refrigerados para transporte aéreo e marítimo, bem como caminhões refrigerados. Esses sistemas são capazes de manter a temperatura interna adequada para o transporte de produtos sensíveis à temperatura. A implementação de um sistema ativo requer investimentos em equipamentos de refrigeração e controle, bem como treinamento adequado para os operadores. Essas adaptações podem proporcionar maior segurança e precisão no controle da temperatura, garantindo a integridade dos produtos transportados.
Por outro lado, os sistemas passivos de controle são aqueles que não possuem um controle ativo de temperatura e/ou umidade. Esses sistemas dependem de isolamento térmico e materiais refrigerantes para manter a temperatura estável durante o transporte. Contêineres termicamente isolados, feitos de poliestireno ou poliuretano, são exemplos de sistemas passivos. No entanto, ao contrário dos sistemas ativos, os sistemas passivos não são capazes de se ajustar automaticamente às variações de temperatura externa. Sua capacidade de manter a temperatura adequada é determinada por meio de estudos e previsões de temperatura e umidade para a rota específica de transporte. O uso de sistemas passivos requer uma análise detalhada das condições climáticas e uma seleção precisa dos materiais de isolamento e refrigerantes apropriados.
 Uma das opções viáveis para adequar a frota de transporte de acordo com a RDC 653/2022 é a utilização de mantas pallet. Essas mantas, devidamente qualificadas, oferecem isolamento térmico e proteção aos produtos sensíveis à temperatura durante o transporte. Ao selecionar mantas pallet adequadas, considerando as características dos produtos e as condições climáticas esperadas, é possível garantir a manutenção da temperatura adequada ao longo da rota, atendendo aos requisitos da regulamentação de forma eficiente e segura.
Uma das opções viáveis para adequar a frota de transporte de acordo com a RDC 653/2022 é a utilização de mantas pallet. Essas mantas, devidamente qualificadas, oferecem isolamento térmico e proteção aos produtos sensíveis à temperatura durante o transporte. Ao selecionar mantas pallet adequadas, considerando as características dos produtos e as condições climáticas esperadas, é possível garantir a manutenção da temperatura adequada ao longo da rota, atendendo aos requisitos da regulamentação de forma eficiente e segura.
Adequar a frota de transporte de acordo com os requisitos da RDC 653/2022 envolve avaliar cuidadosamente os aspectos de qualidade, técnicos e financeiros. É necessário realizar uma análise detalhada dos produtos a serem transportados, das rotas percorridas e das condições ambientais esperadas ao longo do transporte. Com base nessas informações, será possível determinar se é necessário implantar um sistema ativo ou se um sistema passivo será adequado.
Se a decisão for implementar um sistema ativo, serão necessárias adaptações no veículo, como o isolamento térmico do baú e a climatização adequada. Isso envolverá investimentos em equipamentos de refrigeração, sensores de temperatura e umidade, bem como na qualificação dos motoristas e operadores responsáveis pelo controle desses sistemas. Embora a implantação de um sistema ativo possa exigir um investimento inicial mais substancial, pode oferecer maior segurança e precisão no controle da temperatura.
Por outro lado, se a opção for por um sistema passivo, será necessário investir na qualificação adequada de mantas pallets ou embalagens térmicas. Esses materiais devem ser selecionados com base nas características dos produtos a serem transportados e nas condições climáticas esperadas durante o transporte. É fundamental considerar a capacidade de isolamento térmico e a eficiência dos materiais refrigerantes utilizados nessas embalagens. Além disso, é essencial realizar estudos e previsões de temperatura e umidade para garantir que o sistema passivo seja capaz de manter a temperatura adequada ao longo da rota.
Em ambos os casos, a adequação da frota para atender às exigências da RDC 653/2022 requer um planejamento cuidadoso e uma análise completa dos aspectos técnicos e financeiros envolvidos. É importante considerar os custos associados à aquisição e instalação de equipamentos, bem como aos treinamentos necessários para os operadores. Além disso, é fundamental garantir a conformidade com todas as normas e regulamentações relevantes, a fim de evitar penalidades e garantir a integridade dos produtos transportados.
A Qualifica é uma empresa especializada em serviços de assessoria e consultoria com ênfase para a área de qualificação e validação, oferecendo o serviço de mapeamento térmico de rotas e áreas, qualificação de equipamentos e veículos refrigerados, validação de sistemas computadorizados e qualificação de embalagens térmicas. Com uma abordagem objetiva e experiente, a Qualifica auxilia as empresas a atenderem aos requisitos regulatórios e garantirem a segurança e qualidade de seus processos de transporte e armazenamento de produtos sensíveis à temperatura. Saiba mais sobre a nossa consultoria e assessoria e entre em contato
Atualização da RDC 430-2020 pela RDC 653-2022 Mudanças nos Prazos de Adequação das Rotas
A Resolução de Diretoria Colegiada (RDC) 430/2020, que dispõe sobre o transporte de produtos biológicos, foi atualizada pela RDC 653/2022, trazendo modificações significativas, especialmente no que diz respeito aos prazos para adequação das rotas. Essas alterações têm o objetivo de promover maior flexibilidade e adequação às necessidades dos distribuidores e transportadores, sem comprometer a segurança e a integridade dos produtos transportados.

Uma das principais modificações ocorreu no Artigo 64, que trata dos requisitos para o transporte de medicamentos. O parágrafo primeiro desse artigo eliminou a exigência de controle ativo ou passivo para veículos que estejam em rotas previamente qualificadas ou que apresentem condições justificáveis pelo fabricante. Isso significa que, nessas situações específicas, a necessidade de controle rigoroso da temperatura durante o transporte pode ser dispensada, desde que haja uma avaliação prévia que comprove a segurança e a estabilidade dos produtos.
O parágrafo terceiro do Artigo 64 também trouxe uma importante mudança, ao considerar que o monitoramento dos veículos pode levar em conta uma avaliação de riscos para variáveis que não são continuamente controladas. Isso significa que, em vez de monitorar de forma constante todos os parâmetros durante o transporte, poderá ser adotada uma abordagem mais flexível, priorizando a avaliação dos riscos envolvidos e focando naquelas variáveis que podem representar um maior impacto na qualidade dos produtos.
Outro ponto relevante diz respeito à periodicidade do monitoramento térmico, mencionado no Artigo 4. Essa atualização não alterou a frequência de monitoramento, mantendo-se os prazos estabelecidos anteriormente.
No entanto, o Artigo 5 trouxe uma modificação relevante ao eliminar a necessidade de controle de umidade, conforme previsto no inciso III, desde que seja realizada uma avaliação de risco ou justificativas técnicas sejam apresentadas. Isso permite uma maior flexibilidade no transporte de produtos biológicos, especialmente em situações em que a umidade não representa um risco significativo para a qualidade e a estabilidade dos produtos.
Por fim, o parágrafo segundo que tratava da eliminação do monitoramento em rotas com duração inferior a 8 horas, foi revogado. Com isso, a necessidade de monitoramento dos parâmetros durante o transporte se mantém para todas as rotas, independentemente da sua duração.
No que diz respeito aos prazos para adequação, o Artigo 89 da RDC 653/2022 estabeleceu uma mudança significativa. Anteriormente, o prazo era de 1 ano para as empresas se adequarem às novas exigências. No entanto, com a atualização, esse prazo foi estendido para 3 anos, sendo 2 anos destinados ao estudo das rotas e das condições de transporte, e 1 ano para efetivar as adequações necessárias. Essa ampliação do prazo tem como objetivo permitir que as empresas tenham um tempo adequado para se planejar e implementar as mudanças necessárias, garantindo a conformidade com as novas exigências.
Em resumo, a atualização da RDC 430/2020 pela RDC 653/2022 trouxe mudanças relevantes nos prazos para adequação das rotas no transporte de produtos biológicos. Com maior flexibilidade e consideração de avaliações de risco, as alterações visam facilitar o transporte desses produtos sem comprometer a segurança e a qualidade dos mesmos. Os prazos estendidos também proporcionam às empresas um tempo adequado para se adaptarem às novas exigências, garantindo a conformidade com a legislação vigente.
A Qualifica é uma empresa especializada em serviços de assessoria e consultoria com ênfase para a área de qualificação e validação, oferecendo o serviço de mapeamento térmico de rotas e áreas, qualificação de equipamentos e veículos refrigerados, validação de sistemas computadorizados e qualificação de embalagens térmicas. Com uma abordagem objetiva e experiente, a Qualifica auxilia as empresas a atenderem aos requisitos regulatórios e garantirem a segurança e qualidade de seus processos de transporte e armazenamento de produtos sensíveis à temperatura. Saiba mais sobre a nossa consultoria e assessoria e entre em contato
RDC 430-2020 Como qualificar meus fornecedores de maneira correta
A RDC 430/2020 entre em vigor dia 16/03/2021 e uma das principais dúvidas é: O que eu devo cobrar dos meus fornecedores? Saiba mais no post de hoje!
Para a RDC 430/2020 o mais interessante é analisar em primeiro lugar a capacidade que esse fornecedor tem das interpretações dos resultados.
Nos estudos de mapeamento térmico, por exemplo, resultados fora das especificações não caracterizam aprovação ou reprovação de nada, muito pelo contrário, requer uma análise mais profunda dos seus resultados, identificando se ele trará um impacto significativo ou não ao seu processo.

Obviamente quem saberá se esses pontos são críticos ou não é a própria empresa que adquiriu o serviço e não o fornecedor, mas considerar que um fornecedor não tenha esse senso crítico pode complicar um pouco seus estudos;
Em segundo lugar é necessário verificar a infraestrutura que o seu fornecedor apresenta, se ele possui uma equipe técnica robusta capaz de agilizar seus prazos e qual a metodologia utilizada por essa equipe (ela pode ser qualitativa ou quantitativa, baseada em métricas).
Verifique também qual o conhecimento dos guidelines internacionais seu fornecedor possui, muitas vezes se ele ficar com a visão muito focada somente na RDC 430 acenda um sinal de alerta pois você poderá enfrentar alguns problemas lá na frente.
Verifique as instrumentações utilizadas por ele e entenda a metodologia pra cada instrumentação. Compreenda a validação de sistemas computadorizados, esse processo é bem executado com seu fornecedor ou ele não apresenta dados concretos para esses testes?
Analise o conhecimento no processo de qualificação térmica, incluindo armazéns, equipamentos, embalagens e transporte, você precisará desses serviços após realizar os estudos de mapeamento;
Muitas vezes priorizamos os custos ao invés do conhecimento técnico do nosso fornecedor, isso é um grande erro que irá gerar uma enorme dor de cabeça lá na frente.

Busque entender quais os pontos chaves são necessários de execução, compreenda o todo do processo e não apenas o estudo setorial.
Conclusão
A Qualifica oferece cursos, treinamentos e consultorias para a RDC 430/2020, além da execução dos serviços de mapeamento térmico, qualificação, calibração e monitoramento térmico.
Entre em contato e saiba mais!
Os 11 Passos da USP 36 para você realizar o Mapeamento Térmico
O mapeamento térmico é uma exigência da ANVISA e demais órgãos reguladores da distribuição, armazenamento e transporte de medicamentos.
O objetivo é preservar a integridade, bem como garantir a eficácia dos produtos.
É preciso seguir as orientações para não correr risco de sofrer penalidades e, ao mesmo tempo, garantir a eficácia na prestação de serviços.
Se você tem dúvidas sobre mapeamento térmico para a nova RDC 430/2020? Siga os 11 passos da USP 36 e se adéque as boas práticas de distribuição, armazenamento e transporte de medicamentos.
Leia o texto abaixo com bastante atenção.
Mapeamento térmico: como definir se devo ou não mapear a umidade?
Fazer o mapeamento térmico é uma necessidade, orientada pelas normas vigentes, portanto é de conhecimento dos profissionais envolvidos o que deve fazer.
No entanto, quando diz respeito à umidade, essa ainda é uma grande dúvida. Como saber se mapeamos ou não a umidade?
Bom, o primeiro passo para entender a necessidade desse estudo é ir atrás das informações dos detentores do registro e fazer os seguintes questionamentos.
- Eles possuem um estudo de estabilidade robusto para teor de umidade?
- Sabem em qual faixa o produto se mantém estável e por quanto tempo?
Se o detentor tiver todas as informações, então você terá dados concretos para mapear sua umidade.
Caso a situação seja diferente, não fará muito sentido esse estudo. Visto que não haverá um plano de ação definido por parte do detentor ou de qualquer elo da cadeia de suprimentos para o controle da umidade.
Veja abaixo o passo a passo de como fazer o mapeamento térmico da temperatura e umidade.
É importante considerar o fato de que o detentor tenha todos os estudos de estabilidade tanto para temperatura quanto para umidade.
Além disso, é necessário que essa informação esteja registrada em contrato ou na ficha técnica do produto.
Em seguida, o ideal é seguirmos os 11 passos da análise de risco para o mapeamento térmico de armazéns de acordo com o capítulo 1079 da USP 36. Você pode ter o acesso completo ao capítulo 1079 através desse e-book que fizemos. (LINK DO E-BOOK)
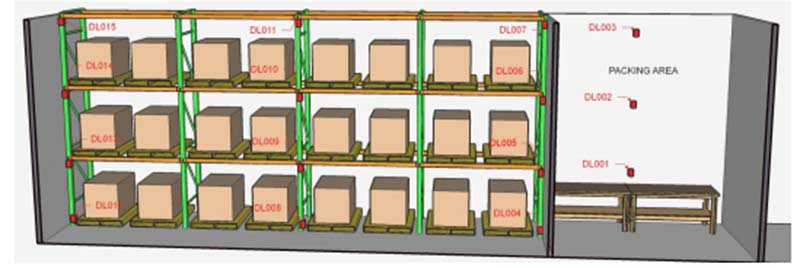
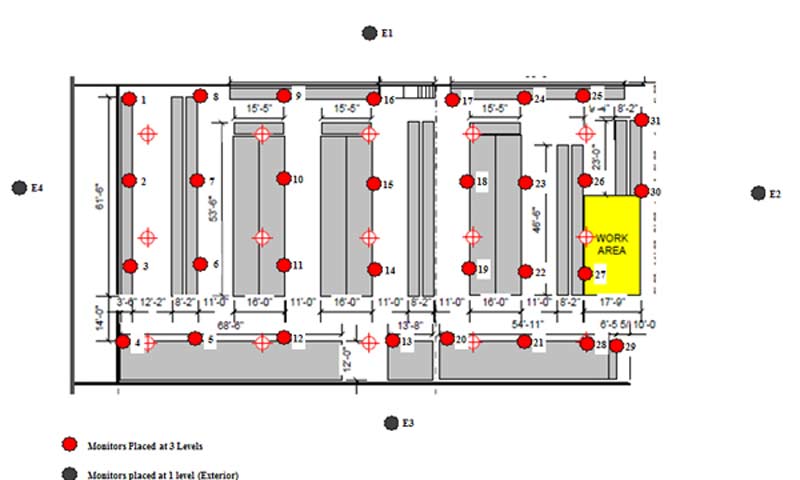
1. Tamanho do armazém
Tenha o croqui em mãos e analise os locais de maior risco tanto para temperatura quanto para umidade. Nesse caso o interessante é analisar portas, corredores, janelas, além da área onde ficam armazenados os medicamentos.
2. Localização do HVAC
O sistema de HVAC também irá impactar tanto na temperatura quanto na umidade do seu armazém. Áreas próximas aos equipamentos tendem a apresentar uma grande troca de calor com o ambiente, impactando nas duas grandezas. Inclusive, o sistema de HVAC necessita de estabilidade para funcionar, sendo essa a principal razão de manter os produtos um pouco mais afastado deles.
3. Incidência solar
A incidência solar pode provocar alterações na estabilidade de alguns medicamentos (fotolábeis). Verifique essas informações com os detentores do registro e evite locais de armazenamento com alta incidência do sol.
4. Altura teto/pé direito
A altura do teto e do pé direito vs a altura dos porta paletes irá impactar diretamente na temperatura de alguns produtos. O ideal é que os produtos que ficarão na parte superior dos porta paletes ou do mezanino não sejam medicamentos e sim suprimentos ou insumos que não necessitem de um controle de temperatura adequado.
5. Localização área de mapeamento
A área de mapeamento precisa ser estudada para não ter a necessidade de mapear o galpão inteiro. Normalmente, o croqui nos dará uma boa base para entender quais áreas necessitam ou não do mapeamento.
6. Corrente de ar interna
A corrente de ar interna irá impactar diretamente tanto na temperatura quanto na umidade. É importante analisar esse item antes, durante e depois do mapeamento, pois os fluxos logísticos podem ser alterados, impactando na corrente de ar.
7. Variação da temperatura externa
Se o galpão a ser mapeado não tiver um sistema de HVAC bem estabelecido, as variações externas da temperatura impactarão diretamente na temperatura interna.
Sendo assim, é por conta desse item que temos a necessidade de mapear na estação mais quente e mais fria pelo período de 7 dias.
Dessa forma é possível ter um embasamento concreto sobre o isolamento térmico do galpão em relação a temperatura externa.
8. Fluxo operacional
Fluxos operacionais bem definidos são sinônimos de baixo risco e baixo custo ao processo. A elaboração do POP deve ser revisada constantemente após todos os estudos de mapeamento, seja sazonal entre as estações, anual, ou de acordo com a necessidade do seu processo. Fluxos ao longo da semana podem ser diferentes aos finais de semana e isto precisa ser metrificado também.
9. Processos de armazenamento e retirada
Se seus processos de recebimento, armazenamento, retirada e expedição não funcionam adequadamente, seus produtos já saem do seu armazém fora das condições adequadas. Se você não possui um processo bem definido, está na hora de cria-los e definir algumas métricas para eles.
10. Capacidade dos equipamentos
Seus equipamentos sejam eles de HVAC ou equipamentos de manutenção térmica dos produtos, necessitam permanecer na capacidade adequada de funcionamento. Sobrecargas podem trazer danos aos produtos, ao processo e a segurança dos seus colaboradores. Verifique todas as capacidades adequadamente antes de iniciar os estudos e qualificações.
11. POP de todos os processos
Não inicie seus estudos sem que o “Manual de Boas Práticas e o Procedimento Operacional Padrão” de todos os seus processos estejam definidos e implementados. Como já dito, os POPs existem como uma excelente ferramenta de suporte ao trabalho diário e deve ser constantemente revisado, inclusive após os estudos.

Mapeamento térmico: sua importância na armazenagem, distribuição e transporte de medicamentos
Os medicamentos não podem sofrer alterações devido às variações climáticas que podem ocorrer durante o transporte.
Por isso, é importante investir no correto mapeamento térmico seguindo as orientações da USP 36. Essa é uma maneira de cumprir com as normas da nova RDC 430/2020.
Essa por sua vez entra em vigor de forma integral em março de 2021, embora algumas regras já estejam sendo aplicadas.
Porém, é preciso começar o quanto antes a executar as mudanças necessárias para que a sua empresa esteja de acordo com as exigências.
O mapeamento térmico é parte fundamental nos cuidados com os medicamentos, por isso é importante que a temperatura seja monitorada e assim a integridade do produto seja mantida.
Buscar informações junto ao fabricante todas as informações necessárias para que as a temperatura adequada seja mantida.
Se durante o monitoramento for percebida qualquer alteração de temperatura é importante tomar as devidas precauções.
Isso é importante para que o problema seja resolvido rapidamente e assim não haja interferência na qualidade dos medicamentos.
As medidas de mapeamento térmico são uma forma de garantir que os pacientes que necessitam dos medicamentos não corram riscos ao fazer o uso.
Uma vez que eles não sofreram qualquer tipo de alteração durante seu armazenado.
Alguns tipos de fármacos são muito mais sensíveis às variações de temperatura, portanto jamais podem ser expostos aos efeitos dela. Veja abaixo alguns tipos:
• Hemoderivados.
• Vacinas.
Registro do Mapeamento térmico
É essencial que todas as ações do processo de monitoramento sejam devidamente registradas. Portanto, fique atento aos itens mais importantes do processo de monitoramento.
- Planejamento de como será a estrutura do local do armazenamento e também dos veículos de transporte.
- Análise de risco: é preciso fazer o levantamento de quais fatores podem influenciar no monitoramento, sendo eles as variações naturais das estações climáticas, bem como a própria estrutura física do local.
- Documentação de todos os passos que envolvem o mapeamento térmico.
- Execução de todas as atividades que visam cumprir as exigências para o correto desenvolvimento térmico;
- Registro dos resultados de todas as análises periódicas para que seja possível fazer uma comparação e assim obter resultados eficazes.
Mapeamento térmico: o Grupo Qualifica é especialista na nova RDC 430/2020
Se mesmo após estudar os 11 principais passos para análise de risco para o mapeamento térmico de armazéns de acordo com o capítulo 1079 da USP 36, você perceber que não consegue aplicar tudo sozinho, peça ajuda.
Portanto, se quiser saber mais informações sobre como se adequar a esta resolução, entre em contato com a gente.
O Grupo Qualifica é especialista na nova RDC 430/2020 e quando o assunto é cold chain, atuando com produtos e serviços tais como mapeamento térmico, monitoramento, calibração e qualificação.
Além disso, fornecemos assessoria na área logística farmacêutica com adequação a legislação, elaboração de protocolos e serviços de excelência.
Tudo isso com um time de especialistas de peso como a ACC Metrologia, a PackID, a Gelotech e a LogMinds.
Por isso, somos a empresa indicada para fazer o mapeamento térmico.
Pois, vamos garantir que a sua prestação de serviços de armazenamento, distribuição e transporta atenda às exigências dos órgãos regulamentares.
Sendo assim, é importante que a RDC 430/2020 seja aplicada de forma integral para garantir a qualidade dos medicamentos, mesmo que eles enfrentem variações de temperatura, no processo de saída da fábrica até o consumidor final.
É importante que os empresários envolvidos na prestação de serviços nesse segmento estejam preparados para atender as regras relacionadas ao mapeamento térmico.
O descumprimento de qualquer uma delas poderá levar a sua empresa a sofrer punições e até mesmo ser proibido de continuar com a execução dos serviços.
Para ajudar a sua empresa a se adequar as novas exigências, o Grupo qualifica dispõe de uma equipe de profissionais devidamente habilitados e especializados nas novas regras.
Ao contratar nossos serviços sua empresa terá todo o suporte que precisa para o mapeamento térmico.
Cumprindo assim todas as exigências e garantindo que os medicamentos sejam transportados com total segurança.
Estamos sempre atualizados sobre as principais mudanças no que diz respeito ao monitoramento e controle de medicamentos no processo de armazenagem, distribuição e transporte desse tipo de produto.
Por isso, oferecemos serviço de consultoria completo para que a sua empresa possa estar integrada às mudanças, nos transformando ano a ano no maior elo entre o seu negócio e o conhecimento técnico.
Nossos produtos
Oferecemos uma gama de produtos para atender as mais variadas necessidades da sua empresa. Veja abaixo o que você vai encontrar:
- Consultorias especializadas: oferecemos soluções completas ligadas à GxP ou BPx.
- Rastreabilidade: somos especializados em oferecer suporte ao Novo Sistema Nacional de Controle de Medicamentos (SNCM).
Uma das melhores iniciativas para controlar toda a rota do medicamento desde o momento em que ele é liberado na fábrica até chegar ao seu destino final.
- Validação e qualificação: se a sua empresa precisa de implementação de métodos e processos, equipamentos e sistemas para ajudar na execução das tarefas diárias e garantir otimização na execução das atividades.
- Transparência X custo-benefício: se você precisa de capacitação eficiente para sua empresa ou terceirizada, temos Know-how para fazer uma participação ativa na capacitação de nossos clientes.
Conclusão
Promover as devidas adequações às normas da RDC 430/2020 é uma obrigação das empresas envolvidas em qualquer uma das etapas de armazenamento, distribuição e transporte de medicamentos.
Embora ela entre em vigor em março de 2021, é preciso que as adequações já comecem a ser feitas.
Além disso, por se tratar de um compilado de outras RDC’s publicadas anteriormente, muitas de suas exigências já estão sendo cumpridas.
Se a sua empresa presta serviço de armazenamento, distribuição e transporte de medicamentos é importante analisar de forma periódica se as normas estabelecidas pela RDC 430/2020 estão sendo cumprida.
O mapeamento térmico tem como principal objetivo garantir que medicamentos e insumos não sofram qualquer tipo de alteração tanto na sua integridade, bem como eficácia.
É importante lembrar que os cuidados com esse tipo de produção, entre eles a manutenção da temperatura ideal é de extrema importância para a saúde pública.
Portanto, é preciso tomar todos os cuidados seguindo as normas regulamentadoras dos órgãos responsáveis.
Se encontrar dificuldades para atender o que a nova RDC 430/2020 exige, busque ajuda de profissionais capacitados para fazer com que a sua empresa seja um exemplo de boas práticas no armazenamento, distribuição e transporte de medicamentos.
Entre em contato ainda hoje com o Grupo Qualifica e tenha a assessoria que precisa para a correta adequação da sua empresa.
Monitoramento Térmico: um Guia completo para sua empresa
Obedecer ao prazo para elaboração do guia de monitoramento térmico é uma forma de manter as atividades da sua empresa dentro da legalidade.
As normas foram publicadas por meio da RDC 430/2020 e são compilados de outras resoluções existentes, portanto revoga a 304/2019 e 360/2020.
Estudar a Resolução da Diretoria Colegiada é forma mais segura de conhecer as regras que deverão ser seguidas e assim se adequar à elas dentro do prazo estabelecido.
O monitoramento térmico é uma das exigências da nova RDC 430/2020 e deve ser feito seguindo todos os critérios exigidos.
Quer saber mais sobre esse assunto? Continue a leitura do texto abaixo com bastante atenção.

GUIA DO MONITORAMENTO TÉRMICO: DO ARMAZENAMENTO AO TRANSPORTE
Uma das primeiras preocupações das empresas envolvidas no armazenamento e transporte de medicamentos é a questão do prazo para adequação às regras da RDC 430/2020.
As exigências têm como principal objetivo garantir a aplicação das boas práticas no que diz respeito ao armazenamento e transporte de medicamento.
E assim assegurar a qualidade dos serviços de saúde pública para a população.
As RDC’s são elaboradas a partir de estudos e discussões realizadas pela Diretoria Colegiada.
Após a conclusão os assuntos são submetidos à consulta pública, para que mais opiniões sejam ouvidas e as adequações possam ser feitas.
Em seguida a esse processo, o documento é publicado no Diário Oficial da União e então aprovada.
A assinatura e aprovação do Diretor Presidente são de vital importância para que as RDC possam ter validade, após cumprimento de todos os passos.
Nesse artigo falaremos especialmente de um aspecto abordado pela RDC/2020 que é o monitoramento térmico tanto na armazenagem como no transporte de medicamentos.
Essa é uma questão muito importante, pois visa assegurar que não haverá oscilações de temperatura, o que seria prejudicial para os medicamentos.
Ou seja, a eficácia e até mesmo a validade de alguns tipos estariam comprometidas.
Por onde começar o monitoramento térmico?
Esse é um questionamento de grande parte das pessoas envolvidas diretamente no armazenamento e transporte de medicamentos.
Continue lendo o texto para que você tenha as informações que precisa.
Para começar é importante entender que a nova RDC 430/2020 entra em vigor em 16 de março de 2021.
Entretanto, o artigo 64 dá um prazo de transitoriedade de 12 meses para a sua empresa se adequar ao monitoramento térmico dos seus processos.
Então a próxima pergunta é: o que eu devo fazer ao longo desses 12 meses? O fiscal da vigilância sanitária vai multar a minha empresa se ela não estiver adequada nesse prazo?
Vamos com calma!
O primeiro passo é estudar a nova RDC 430/2020 que entrará em vigor no dia 21 de março de 2021. Em seguida é preciso começar seus estudos de monitoramento térmico, tanto de armazém quanto de rota.
Esses estudos já nos darão grandes informações a respeito do comportamento térmico de todo o fluxo de distribuição, armazenamento e transporte.
Embora não seja muito comentado, você precisa saber de uma informação bastante relevante.
Durante os estudos você pode começar um plano amostral para o monitoramento térmico do seu processo, analisando o que apresenta maior ou menor risco.
Esse plano amostral pode ser definido unindo os estudos de monitoramento térmico com o relatório de qualificação térmica.
Para que você entenda o plano amostral, precisamos entender o que é o mapeamento térmico, qualificação térmica e monitoramento térmico.
Veja abaixo as explicações:
Mapeamento térmico
- É o estudo do comportamento da temperatura e umidade dos seus processos logísticos de acordo com as boas práticas de distribuição, armazenamento e transporte.
Não apresenta caráter de aprovação, sendo apenas um guia para com que você possa estabelecer um CAPA com maior assertividade. SAIBA OS 11 PASSOS DO MAPEAMENTO TÉRMICO ATRAVÉS DA USP 36. CLIQUE PARA ACESSO
Qualificação térmica
- É um conjunto de testes realizados para definir a capacidade e o comportamento térmico de um determinado equipamento ou sistema. Apresenta caráter de aprovação, ou seja, tem o poder de aprovar ou reprovar o equipamento ou sistema térmico analisado.
Monitoramento térmico
- É um sistema de análise constante do comportamento térmico de todos os processos logísticos. A RDC 430 considera constante e não contínuo o monitoramento térmico, devido ao fato que o processo será monitorado apenas na necessidade da distribuição, armazenamento e transporte.
Esses três conceitos, junto à análise de risco, requerimento do usuário, manual de boas práticas e procedimento operacional padrão atualizado, serão responsáveis pela validação do seu processo de distribuição, armazenamento e transporte de medicamentos.
Agora que já entendemos os conceitos vamos para a prática!
Para iniciar um plano amostral no monitoramento térmico, precisamos entender o quanto de conhecimento nós temos de determinado processo.
Pois o conhecimento é inversamente proporcional ao monitoramento, ou seja, quanto mais eu conheço. Menos eu monitoro.
Defina através da sua análise de risco quais são suas rotas críticas, quais equipamentos exigem maior atenção, qual localização do seu armazém é a mais crítica e estabeleça esses pontos de medições.
Para as rotas, delimite um prazo de verificação constante. Isso irá te ajudar no entendimento do comportamento de determinada rota. KPIs são essenciais nesse momento.
Responda as seguintes perguntas:
- Qual a distância dessa rota.
- Qual a frequência de envios.
- Pontue eventuais observações, reclamações, devoluções, etc.
- Metrifique quais são as mais importantes no seu processo.
- Estabeleça um plano de ação para otimizá-las e então periodicamente analise essas métricas através do monitoramento térmico.
- Faça essas análises no curto, médio e longo prazo e faça a comparação entre outras rotas.
Entenda quais estão apresentando resultados melhores, iguais ou piores.
Nesse momento você encontrará o fator chave do seu monitoramento, intensificando, mantendo ou diminuindo em determinada localidade.

Monitoramento térmico: conheça as exigências da RDC 430/2020
Veja abaixo quais são as principais regras para as empresas que trabalham diretamente com a armazenagem e transporte de medicamentos.
- É preciso seguir corretamente as exigências do fabricante no que diz respeito à armazenagem dos medicamentos;
- Os medicamentos que não estiverem devidamente armazenados e não forem transportados na temperatura adequada devem ter seu recebimento rejeitado.
- As condições de armazenagem e transportes exigidas pelo fabricante devem ser registradas nos arquivos eletrônicos de expedição.
- As transportadoras devem ser rigorosamente treinadas e qualificadas para executar o serviço de transporte de medicamentos, mesmo que sejam terceirizadas.
- É preciso disponibilizar profissionais devidamente especializados, leia-se Responsável Técnico para prestar assistência, bem como averiguar as condições do transporte em caso de acidentes.
- Manter todas as condições exigidas pela vigilância sanitária, bem como do fabricante de medicamentos, aplicando os sistemas passivos e ativos de controle de temperatura de acordo com a necessidade.
- As empresas deverão ainda verificar as condições de temperatura durante o transporte e armazenamento com equipamentos devidamente calibrados.
- Manter um relatório atualizado sobre as condições de temperatura conservada durante o transporte e do armazenamento em trânsito.
- Deixar claro a restrição de acesso aos medicamentos.
- Seguir estritamente as exigências do monitoramento térmico, salvo quando comprovado em registro, o tempo máximo de transporte de até 08 horas. Nesse caso, é preciso verificar se as embalagens térmicas estão de acordo com a qualificação térmica requerida para o transporte.
- Em hipótese alguma pode haver violação da carga de medicamentos.
- É imprescindível a correta adequação dos veículos e contêineres sejam seguros e não ofereça qualquer tipo de risco para a carga de medicamentos, inclusive a contaminação.
- Na hipótese de transportar outro tipo de carga no mesmo veículo avaliar os riscos, antes de executar o serviço.
Monitoramento térmico: deixa a Qualifica cuidar de tudo para você
O monitoramento térmico é essencial no armazenamento e transporte de medicamentos, pois visa garantir que os produtos não sofrerão danos devido às oscilações climáticas.
Por isso, essa etapa deve ser realizada por profissionais especializados e experientes na realização do monitoramento, garantindo a qualidade e a integridade do produto.
Além disso, é preciso ter uma base de conhecimentos técnicos para garantir que todos os estudos serão feitos tendo por base as exigências legais.
Sendo assim se a sua empresa está envolvida na atividade de armazenamento ou transporte de medicamentos, é essencial estudar e entender cada ponto da RDC 430/2020.
Essa é a única forma de garantir que a sua empresa vai cumprir todas as exigências. Assim, os medicamentos serão armazenados e transportados de acordo com a temperatura ideal de acordo com o seu fabricante.
Evitar ser pego pela fiscalização da Vigilância Sanitária é a única forma de assegurar que a sua empresa poderá executando serviços ligados à logística de medicamentos.
Para que a sua empresa exerça as funções de acordo com a lei é preciso escolher de forma criteriosa os responsáveis pelos estudos que antecedem o monitoramento térmico.
O Grupo Qualifica é especialista na nova RDC 430/2020 e quando o assunto é cold chain, atuando com produtos e serviços tais como mapeamento térmico, monitoramento, calibração e qualificação.
Além disso, fornecemos assessoria na área logística farmacêutica com adequação a legislação, elaboração de protocolos e serviços de excelência.
Tudo isso com um time de especialistas de peso como a ACC Metrologia, a PackID, a Gelotech e a LogMinds.
Nossos produtos
Ao contratar nossos serviços sua empresa terá todo o suporte que precisa para o monitoramento térmico cumprindo todas as exigências e garantindo que os medicamentos sejam transportados com total segurança.
Estamos sempre atualizados sobre as principais mudanças no que diz respeito ao monitoramento e controle de medicamentos.
Por isso, oferecemos serviço de consultoria completo para que a sua empresa possa estar integrada às mudanças, nos transformando ano a ano no maior elo entre o seu negócio e o conhecimento técnico.
Oferecemos uma gama de produtos para atender as mais variadas necessidades da sua empresa. Veja abaixo o que você vai encontrar:
- Consultorias especializadas: oferecemos soluções completas quando o assunto é a logística farmacêutica.
- Regulatórios: somos especialistas nos processos regulatórios de abertura de empresas e adequações às normas e legislações.
- Trilha de validação: executamos todos os serviços para garantir o status validado dos seus processos, da calibração, passando pelo mapeamento, qualificação e monitoramento térmico dos seus processos.
- Transparência X custo-benefício: se você precisa de capacitação eficiente para sua empresa ou terceirizada, temos Know-how para fazer uma participação ativa na capacitação de nossos clientes.
Para que a sua empresa tenha sempre a melhor prestação de serviço, nossa equipe está constantemente se atualizando e buscando as informações mais recentes do mercado.
Dessa forma, podemos oferecer à sua empresa uma assessoria de qualidade de acordo com as mais novas publicações dos órgãos competentes.
Abrir mão de seguir as adequações exigidas pela Vigilância Sanitária no que diz respeito ao armazenamento, distribuição e transporte de medicamentos é o mesmo que abrir precedentes para não mais atuar no mercado nesse segmento.
Conclusão
Se a sua empresa está envolvida em qualquer uma das etapas de transporte, armazenamento e distribuição de medicamentos, ela deve se adequar às normas da RDC 430/2020.
Ela consiste em um compilado das RDC anteriores, portanto, as regras existentes nela devem ser seguidas, para que a sua empresa não sofra com sanções legais.
Para não correr riscos, o ideal é estudar de forma minuciosa todas as informações para não deixar nenhuma exigência sem ser cumprida.
O Monitoramento Térmico deve ser feito de acordo com a RDC 430/2020, para que os medicamentos sejam armazenados e transportados segundo os critérios estabelecidos.
Essa é uma forma de garantir a integridade e qualidade dos medicamentos e também preservar a saúde pública.
As condições exigidas pela vigilância sanitária e também pelo fabricante do medicamento devem ser respeitadas para assegurar a eficácia do mesmo ao ser usado.
Não permita que a sua empresa corra riscos de sofrer sanções dos órgãos reguladores ou até mesmo fique impedida de transportar, armazenar ou distribuir medicamentos, pelo não cumprimento das exigências.
Entre em contato ainda hoje com o Grupo Qualifica e tenha a melhor assessoria para o monitoramento térmico da sua empresa e demais atividades voltadas para o desenvolvimento do seu negócio.
Como otimizar os custos no Mapeamento de Rotas?
O mapeamento de rotas é parte integrante do serviço de transporte de medicamentos e não pode jamais ser negligenciado.
Ele faz parte da manutenção da qualidade do produto transportado, de forma que ele não sofra com interferências causadas pelas variações climáticas.
No entanto, muitas empresas envolvidas com atividade de transporte de carga de medicamentos tem se deparado com orçamentos altíssimos, o que pode acabar inviabilizando a execução do mapeamento.
Mesmo diante das dificuldades é importante frisar que o mapeamento térmico está previsto na nova RDC 430/2020, portanto, fazê-lo se tornou uma obrigatoriedade.
Por isso, é importante buscar alternativas para otimizar os custos no mapeamento de rotas e assim cumprir as exigências legais.
Quer aprender como reduzir custos no mapeamento sem descumprir as exigências do RDC 430/2020? Leia o texto a seguir com bastante atenção.
Mapeamento de rotas: como otimizar os custos?
A melhor forma de otimizar os custos é por meio de estudos de mapeamento térmico da nova RDC 430/2020, pois, se trata de uma exigência dela.
Ele é a base fundamental para entendermos o comportamento térmico do seu transporte, ou seja, é o momento de entender quais as possíveis variações climáticas acontecerão durante o trajeto.
No entanto, empresas especializadas nesse estudo estão cobrando valores bastante elevados, o que acaba se tornando uma barreira na execução do estudo.
Porém, é possível avaliar alguns indicadores e assim conseguir otimizar os custos na hora da solicitação do orçamento e execução dos testes.
Conheça os 5 indicadores que podem te ajudar a reduzir os custos do mapeamento de rotas
-
Relação 80/20
- A relação 80/20 nada mais é do que 20% das suas rotas que representam 80% da sua expedição. Essa proporção não é exata, mas pode te ajudar muito a encontrar quais rotas você pretende mapear e otimizar seus custos.
Uma dica é que caso sejam encontradas inúmeras rotas nessa proporção você pense em uma porcentagem menor de cobertura, algo em torno de 60 a 70%. Não há na literatura uma definição específica quanto a esse assunto, inclusive a WHO junto com a ISTA SUGEREM algo em torno de 90%, o que encarece demais o estudo.
-
Plano Amostral
- Ao definir quais rotas serão analisadas, vá para o plano amostral. Esse plano deve ser robusto o suficiente para dar base a qualificação térmica.
Normalmente, três amostras verão e três amostras inverna já são o suficiente para parametrizar o comportamento térmico de uma determinada rota. Mas esse plano amostral final vai depender da sua análise de risco.
Novamente, a WHO junto com a ISTA sugerem que os estudos sejam feitos ao longo de 52 semanas com pelo menos 25 amostras por variável, mas consideram estatisticamente válidos a partir de 30 amostras.
Esse seria o cenário ideal e perfeito, mas sabemos da realidade e do custo que isso impactaria no processo.
-
Logística Reversa
- A logística reversa é um dos itens que mais apresenta redução de custos ao ser realizado. Esse método consiste em a empresa que está solicitando os serviços ser responsável sob a guarda e retorno dos data loggers para a empresa prestadora do serviço.
Com isso, evita-se os custos de deslocamento dos colaboradores da prestadora, otimizando e muito o valor final da proposta.
-
Estudo de umidade
- O estudo de estabilidade é requerido na RDC 430/2020, porém é necessário estabelecermos um racional da sua viabilidade entre a empresa detentora do registro e a sua instituição.
Muitas vezes, as empresas detentoras não possuem um estudo de estabilidade robusto sobre essa grandeza, e por vezes sequer tem conhecimento do teor de umidade correto para manter o medicamento em condições adequadas.
Sendo assim, e somente quando possível, claro, você pode solicitar apenas os estudos de mapeamento térmico e controlar a umidade na trilha final da RDC que é o monitoramento térmico.
Mas lembre-se, faça isso apenas se for viável essa opção, caso o detentor tenha os estudos, prossiga com a solicitação do mapeamento de umidade.
-
Frequência das leituras
- A frequência indicada das leituras pode ser de 10 a 30 minutos, de acordo com os suplementos técnicos da WHO.
Se você possui certo conhecimento da sua rota, não há nada de errado aumentar o prazo de frequência das leituras. O padrão é de 10 a 15 minutos, isso pode auxiliar na otimização de custos, reduzindo hora/trabalho do funcionário da prestadora de serviço.
Não é uma otimização tão considerável assim, mas se você busca redução de custos essa pode ser uma alternativa.
É importante ressaltar que as sugestões descritas nesse artigo requerem estudo de viabilidade e análise de risco prévio.
Não se limite a embasar suas solicitações simplesmente porque você leu aqui, pois, muitas vezes poderá não ser seu caso. É importante buscar a adequação à realidade da sua empresa.
Conhecimento e dedicação além do requerido é peça fundamental na área da qualidade. Nunca se esqueça disso!
Para que a eficácia do medicamento seja conforme o objetivo de sua fabricação é preciso que as regras de armazenamento e transporte sejam criteriosamente seguidas.
Por isso, é importante que o estudo para mapeamento de rotas seja feito de forma criteriosa, fazendo o correto levantamento das variações climáticas em que o medicamento estará sujeito.
Mapeamento de rotas: exigências da RDC 430/2020
Para otimizar os custos do mapeamento de rotas é preciso conhecer bem as exigências da RDC 430/2020 para cumprir cada uma delas.
É importante frisar que as exigências têm como principal objetivo preservar a integridade dos medicamentos e garantir que ele chegue até seu destino em perfeito estado.
Além disso, o mapeamento de rotas ainda garante que as oscilações climáticas das regiões por onde a carga passar não interfira de forma adversa na qualidade do produto.
É importante ressaltar que os medicamentos são produzidos para atender demandas de saúde e são fabricados seguindo critérios rigorosos.
Sendo assim, esse assunto precisa ser lavado à sério de tal forma, que todo o processo de transporte da carga seja devidamente monitorado.
Estar atento às exigências da RDC 430/2020 é a melhor forma de garantir que a sua empresa não terá problemas com a fiscalização da vigilância sanitária.
Veja abaixo quais delas estão inteiramente ligadas à questão do transporte e consequentemente influenciam também no mapeamento.
É importante frisar que mesmo que a contratação do serviço de transporte dos medicamentos seja terceirizado, a empresa deverá seguir todas as exigências.
De acordo com o artigo 64 da RDC 430/2020 a empresa que realizar o transporte dos medicamentos deverá apresentar um manifesto coma previsão de desembarque dos produtos.
É preciso que esse documento esteja em local de fácil acesso dentro do veículo.
Além disso, a empresa que optar pela terceirização do transporte dos medicamentos deverá oferecer todo o treinamento necessário, inclusive apresentando o mapeamento de rotas que deverá ser seguido à risca.
Mapeamento de rotas: veja o que mais sua empresa precisa cumprir
Outra exigência é a prestação de suporte técnico especializado em caso de acidentes com a carga.
É preciso contratar um profissional técnico para que ele possa avaliar a situação no momento e contribuir com a melhor decisão a ser tomada.
Além disso, ela precisa apresentar alguns documentos importantes. Eles devem ser de fácil acesso, em caso fiscalização.
Veja abaixo quais são eles:
- Monitoramento constante das condições de transporte no que diz respeito à temperatura, armazenagem, umidade e dos medicamentos transportados.
- Todas as medições devem ser feitas com equipamento devidamente calibrado.
- Aplicação correta dos sistemas ativos e passivos de controle de temperatura dos medicamentos de acordo com as exigências do fabricante;
- Oferecer informações claras e precisas sobre as condições adequadas para transporte, conservação e armazenagem em trânsito.
- Não permitir acesso de pessoas desconhecidas aos medicamentos, essa é uma forma de evitar a exposição do produto que pode ficar sujeito à contaminação, violação e até mesmo roubo ou furto.
- Fazer o devido mapeamento da rota de forma antecipada e exigir que ele seja seguido.
- Adequar as cargas às situações previstas na RDC 430/2020, tais como tempo de transporte inferior a 08 horas, caso os medicamentos sejam transportados em embalagens térmicas que adequadas às condições do transporte.
- Demonstração expressa de que somente pessoas autorizadas poderão ter acesso à carga.
- Informar que a violação de qualquer embalagem de medicamentos é expressamente proibida.
- Os veículos, bem como seus compartimentos e containers não devem oferecer condições seguras ao transporte dos medicamentos, de forma que eles não fiquem expostos à violação da carga, bem como contaminações de qualquer tipo.
- Os veículos e seus compartimentos devem passar por manutenção e limpeza periódicas.
Mapeamento de rotas: como o Grupo Qualifica pode ajudar a sua empresa
É preciso decidir quem será responsável pela elaboração do mapeamento de rotas.
Essa ação pode ser executada pela sua empresa ou por uma terceirizada.
Tomar essa decisão é algo que exige análise prévia, pois, a redução de custos não pode colocar a qualidade do transporte em jogo.
Ou seja, se a sua empresa é responsável pelo transporte, armazenamento e distribuição de medicamentos, é preciso que os gestores estejam atentos às exigências da RDC 430/2020.
Se alguma delas for descumprida, sua empresa poderá sofrer sanções e inclusive ser obrigada a deixar de transportar ou fazer qualquer outra atividade ligada à logística de medicamentos.
Para ajudar a sua empresa a se adequar as novas exigências, o Grupo qualifica dispõe de uma equipe de profissionais devidamente habilitados e especializados nas novas regras.
O Grupo Qualifica é especialista na nova RDC 430/2020 e quando o assunto é cold chain, atuando com produtos e serviços tais como mapeamento térmico, monitoramento, calibração e qualificação.
Além disso, fornecemos assessoria na área logística farmacêutica com adequação a legislação, elaboração de protocolos e serviços de excelência, tudo isso com um time de especialistas de peso como a ACC Metrologia, a PackID, a Gelotech e a LogMinds.
Ao contratar nossos serviços sua empresa terá todo o suporte que precisa para o mapeamento de rotas cumprindo todas as exigências e garantindo que os medicamentos sejam transportados com total segurança.
Estamos sempre atualizados sobre as principais mudanças no que diz respeito ao monitoramento e controle de medicamentos.
Por isso, oferecemos serviço de consultoria completo para que a sua empresa possa estar integrada às mudanças, nos transformando ano a ano no maior elo entre o seu negócio e o conhecimento técnico.
Nossos produtos
Oferecemos uma gama de produtos para atender as mais variadas necessidades da sua empresa. Veja abaixo o que você vai encontrar:
- Consultorias especializadas: oferecemos soluções completas ligadas à GxP ou BPx.
- Rastreabilidade: somos especializados em oferecer suporte ao Novo Sistema Nacional de Controle de Medicamentos (SNCM), uma das melhores iniciativas para controlar toda a rota do medicamento desde o momento em que ele é liberado na fábrica até chegar ao seu destino final.
- Validação e qualificação: se a sua empresa precisa de implementação de métodos e processos, equipamentos e sistemas para ajudar na execução das tarefas diárias e garantir otimização na execução das atividades.
- Transparência X custo-benefício: se você precisa de capacitação eficiente para sua empresa ou terceirizada, temos Know-how para fazer uma participação ativa na capacitação de nossos clientes.
Conclusão
Todas as empresas que são envolvidas de forma direta ou indireta no transporte, armazenamento e distribuição de medicamentos devem de adequar às normas da RDC 430/2020.
Caso enfrentem algum tipo de dificuldade, podem contratar uma empresa qualificada que ofereça todo o suporte para que as adequações sejam feitas.
O mapeamento de rotas é um estudo sobre as variadas condições em que o medicamento estará exposto durante o tempo de transporte. Com esses resultados em mãos será possível elaborar estratégias para que a temperatura adequada seja mantida.
Cuidar desse aspecto é garantir a qualidade do produto de forma que as variações climáticas não interfiram na sua eficácia ao ser consumido.
É importante lembrar que qualquer problema durante o transporte de carga de medicamentos, pode oferecer sérios riscos à saúde pública.
Entre em contato ainda hoje com o Grupo Qualifica e tenha a assessoria que precisa para a correta adequação da sua empresa.
Como Elaborar o Manual de Boas práticas de distribuição, Armazenamento e Transporte?
Para elaborar o manual de boas práticas de distribuição, armazenamento e transporte é preciso ficar atento ás exigências da nova RDC 430/2020 que passa a vigorar à partir de 13 de março de 2021.
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária se reuniu com o objeto de estabelecer requisitos mais rigorosos como forma de cuidados com a saúde pública.
A nova RDC 430/2020 revoga a 304/2019 e a 360/2020, formando um compilado com o que de há mais importante para orientar os responsáveis pelo transporte desse tipo de produto.
A partir dessa mudança é preciso investir na elaboração do manual de boas práticas de distribuição, armazenamento e transporte.
É importante que a empresa elabore os documentos: manual e POP’s de acordo com as atividades desempenhadas por ela.
Mas como elaborar esse manual e conseguir atender as exigências legais para não ter problemas com a Vigilância Sanitária?
Essa é uma dúvida bastante comum dos empresários donos de empresas envolvidas na logística de medicamentos.
Quer aprender como solucionar esse problema? Continue conosco lendo o texto abaixo com bastante atenção.
Manual de boas práticas de distribuição, armazenamento e transporte: como elaborar? Por onde começar?
Sua empresa precisa apresentar o manual de boas práticas e o procedimento operacional padrão de todos os seus fluxos operacionais de acordo com a nova RDC 430/2020 a partir de Março de 2021.
O manual de boas práticas de distribuição, armazenamento e transporte é conhecido como o DNA da empresa.
Ou seja, é a forma detalhada de apresentar a qualidade de serviços prestados ao mercado.
Nesse documento é preciso conter de maneira simplificada todos os processos logísticos desta companhia.
Inclusive quais os principais objetivos que a instituição quer alcançar no curto, médio e longo prazo.
Sendo assim, muito mais que elaborar o manual de boas práticas de distribuição, armazenamento e transporte, toda essa organização contribuirá para que a empresa possa organizar seus fluxos.
Ou seja, é uma espécie de plano de negócios na área da qualidade e logística, sendo interessante conter um breve histórico sobre a empresa.
Veja algumas informações importantes que precisam conter:
- Atividade da empresa;
- Abrangência,
- Expediente;
- Fluxo colaborativo,
- Missão,
- Visão,
- Valores da empresa.
Ao concluí-lo você deverá começar a produção do procedimento operacional padrão (POP), por isso deve ser um documento mais específico e individual.
As informações contidas nele devem ser detalhadas de cada processo da companhia.
É importante que esse documento seja de fácil acesso, além disso, ele deve ser periodicamente revisado pelos responsáveis do setor.
É interessante realizar treinamentos frequentes entre os colaboradores, tanto do manual de boas práticas quanto dos POPs (Procedimento Operacional Padrão).
É importante considerar os POP’s como o mais importante para evitar riscos operacionais, físicos, de qualidade e financeiros à instituição.

Quais os itens mais importantes na elaboração do manual de boas práticas de distribuição e armazenamento e dos POP’s no aspecto de qualidade para a sua empresa.
O primeiro e mais importante passo para começar a elaborar o manual de boas práticas de distribuição, armazenamento e transporte da sua empresa é conhecer bem os processos da da empresa.
Esse conhecimento será a base para o que o manual seja completo, assim como os POP’s.
Além disso, é preciso que ambos os documentos sejam feitos de acordo com as atividades da empresa, tendo como exemplo, uma transportadora.
Ela não precisa elaborar um manual de boas práticas com a abordagem na atividade de distribuição e armazenagem, pois sua atividade principal é o transporte.
Da mesma forma, as outras empresas que desempenham outras atividades como distribuição e armazenagem, não precisam focar em transporte.
Ou seja, o responsável por elaborar o manual de boas práticas de distribuição, armazenamento e transporte, precisa conhecer bem a atividade que a empresa desempenha para fazer tudo de forma adequada.
Visando preservar a qualidade da prestação de serviço, é importante considerar alguns pontos cruciais que devem ser inseridos no manual de boas práticas e também nos POP’s.
Veja abaixo alguns itens que devem ser descritos no manual de forma breve e nos POP’s de forma detalhada
POLÍTICA DA QUALIDADE
É importante descrever como são realizados os seguintes tópicos:
-
Treinamentos
- Como são realizados e com qual frequência. Descreva se possível a pontuação média dos colaboradores de uma maneira geral (isso pode ser importante na melhora da capacitação e compreensão dos funcionários aos processos da empresa);
-
Autoinspeção
- Como é realizada a autoinspeção, descreva também como são os procedimentos de auditoria interna;
-
Rastreabilidade
- Qual o nível de conhecimento e transparência dos seus fluxos operacionais? Toda a companhia tem fácil acesso a esses dados? Eles são medidos com eficiência? Quais tecnologias são utilizadas? Por quanto tempo os dados são armazenados?
FACILITIES
É importante identificar como são feitos os seguintes tópicos:
-
Limpeza e manutenção da área logística;
- Quais produtos são utilizados? Eles apresentam algum risco ao processo? Qual a frequência da limpeza e em quais horários ela é realizada?
-
Programa de Gerenciamento de Resíduos;
- Quais resíduos são gerados? Como é feito o descarte ou reaproveitamento? Qual o impacto ambiental desse processo?
-
Controle de Pragas;
- Qual a periodicidade e qual controle é feito? Qual o protocolo de intervenção com os colaboradores?
-
Sistema de Segurança;
- Onde ficam armazenados os dados? Quanto tempo eles permanecem registrados? Quem tem acesso aos dados?
Descreva sobre os responsáveis pela execução dos serviços
É muito importante descrever os detalhes de como o processo é realizado internamente ou se há a contratação de uma empresa terceirizada.
Se esta for a situação é preciso descrever todos os dados da executora do serviço.
Caso seja a própria empresa responsável pela limpeza e controle de pragas, é preciso descrever de forma clara qual o setor é responsável.
Além disso, descrever quais as funções definidas para cada um dos colaboradores desse departamento em relação a essa atividade.
Além disso, crie um item apenas para a descrição de cada POP, pode ser um item curto onde será registrado quantos POPs existem e quais são eles.
Por fim, não se esqueça de colocar o fluxo operacional e organograma da sua empresa, faça da maneira que julgar mais necessário, sendo como um arquivo anexo ou fazendo parte do conteúdo do manual.
Escrever o Manual de Boas Práticas de Distribuição, Armazenamento e Transporte é uma atividade que exige dedicação e conhecimento interno do funcionamento da empresa.
Portanto, seja na elaboração do manual ou até mesmo dos POP’s, é muito importante que o responsável pela execução de ambos entenda seus processos e funcionamento da empresa.
Muito mais que descrever o manual e o POP’s todas as informações descritas nesses documentos visam estimular o seu raciocínio e não necessariamente precisam ser como descritos.
Boas práticas de distribuição, armazenamento e transporte: quais os critérios é preciso respeitar
É importante que a empresa fique atenta às exigências da nova RDC 430/2020, especialmente àquelas que estão ligadas a atividade desenvolvida.
Portanto, procure ler a Resolução na íntegra para obter as informações de acordo com a atividade desempenhada.
Veja abaixo algumas dicas importantes para cada setor em especial:
Distribuição
As empresas envolvidas na distribuição de medicamentos devem observar os seguintes critérios:
- Na distribuição dos medicamentos respeitadas e executar os testes de mapeamento térmico. Saiba como executar o mapeamento térmico através dos 11 passos da USP 36
- É preciso que a documentação ao lote, data de validade, bem como quantidades recebidas estão de acordo com o pedido efetuado e as notas fiscais.
- A carga deve estar sem nenhum tipo de violação.
- Em caso de descumprimento de qualquer um dos itens acima devem ser devolvidas e até que seja verificada sua integridade e disposição para entrega.
- O fracionamento dos medicamentos deve ser feito de acordo com as orientações específicas à quantidade estipulada.
- Os arquivos eletrônicos referentes à distribuição devem conter informações completas. Tais como nome e documentos da empresa responsável pelo transporte, documentos do motorista, quantidade, relatório com as condições de armazenagem, nota fiscal, entre outros.
- No momento de elaborar o cronograma de entrega, bem como as rotas, informações tais como as condições locais e as necessidades, devem ser respeitadas.
Armazenamento de medicamentos
Em situações em que a empresa seja responsável armazenamento de medicamentos, ela também terá que observar alguns critérios.
Veja abaixo quais são eles:
- É preciso seguir todas as orientações de armazenamento de acordo com as exigências do fabricante;
- O local destinado ao armazenamento dos medicamentos não deve ter incidência de luz solar direta que possa refletir sobre eles.
- É preciso respeitar uma distância média da parede para que não haja contato dela com o produto armazenado, bem como eles também não devem ser colocados no chão;
- É preciso que os palets onde os medicamentos ficarão sejam de material de fácil limpeza e que não favoreça a contaminação.
- É preciso ter apenas um local de destino, para evitar trocas.
- Faça inventários com uma determinada periodicidade para verificar as adequações do local e do produto armazenado. Quaisquer inconsistências devem ser averiguadas para que a carga não seja alvo de crimes, tais como roubos e furtos.
- Não ultrapassar o limite de carga estipulado pelo fabricante para evitar danos aos medicamentos.
Transporte
Quando a empresa é responsável apenas pelo transporte é preciso respeitar as exigências da nova RDC 430/2020, ao que diz respeito às boas práticas de distribuição, armazenamento e transporte, é preciso que ela esteja atenta aos critérios.
Veja abaixo quais são eles:
- Qualificação das transportadoras antes de executar o serviço.
- Disponibilizar um responsável técnico para prestar assistência em caso de acidentes envolvendo os medicamentos de forma a preservar a integridade e a qualidade deles.
- Apresentar manifesto da carga transportada com informações relativas ao desembarque.
- Fazer cumprir às exigências realizar o estudo de mapeamento térmico de rotas e qualificar as suas rotas para cumprir as exigências do artigo 64 da RDC 653/2022
- Atender as exigências do registro sanitário, bem como outras especificações de forma a aplicar o sistema ativo e passivo para controlar a temperatura e umidade adequada.
Manual de boas práticas de distribuição, armazenamento e transporte: como o Grupo Qualifica pode ajudar sua empresa
DESCUBRA O GRUPO QUALIFICA!
Elaborar o manual de boas práticas de distribuição, armazenamento e transporte é uma necessidade para todas as empresas envolvidas em qualquer uma das atividades citadas.
Se a sua empresa ainda não se adequou à nova resolução, não se engane pensando que possui 1 ano pela frente. Algumas exigências já serão cobradas e você poderá ter muitos problemas.
O Grupo Qualifica é especialista na nova RDC 430/2020 e quando o assunto é cold chain, atuando com produtos e serviços tais como mapeamento térmico, monitoramento, calibração e qualificação.
Além disso, fornecemos assessoria na área logística farmacêutica com adequação a legislação, elaboração de protocolos e serviços de excelência. Tudo isso com um time de especialistas de peso como a ACC Metrologia, a PackID, a Gelotech e a LogMinds.
Se a sua empresa precisa de ajuda para atender as exigências da nova resolução, entre em contato conosco ainda hoje.
O transporte, bem como o armazenamento de medicamentos e a distribuição são assuntos sérios e devem ser tratados como tal.
Por isso, é importante contratar os serviços de uma empresa que de fato entenda do assunto e disponibilize profissionais capacitados para ajudar a sua empresa.
Conclusão
Todo o cuidado deve ser tomado em relação ao transporte, armazenado e distribuição dos medicamentos, afinal de contas eles servem para aliviar dores, tratar e até mesmo curar doenças.
Antes de chegarem até às farmácias, foi preciso muito tempo de estudo para descobrir as fórmulas adequadas para tipo de moléstia.
Além disso, há grandes investimentos para que a medicação possa chegar à cada pessoa que necessita seja pelo Sistema Único de Saúde e pela iniciativa privada.
Não atender as exigências do fabricante e as normas estipuladas pela Anvisa por meio da nova RDC 430/2020 é colocar em risco a saúde da população.
Entre em contato hoje ainda com o Grupo Qualifica e tenha toda a assessoria que você precisa para elaborar o manual de boas práticas de distribuição, armazenamento e transporte para que a sua empresa possa oferecer um serviço de qualidade e se manter no mercado.